 山口大学共同獣医学部 病態制御学講座 獣医衛生学分野 助教 渋谷周作 先生
山口大学共同獣医学部 病態制御学講座 獣医衛生学分野 助教 渋谷周作 先生
No.18 アミノ酸とタンパク質の「合成と分解」
– 細胞の中で何が起こっているのか、秘密を探る-

山口大学共同獣医学部 病態制御学講座
獣医衛生学分野 助教
渋谷周作 先生
専門分野:細胞生物学
経歴:
2003 年3月 東京大学農学部 獣医学専修 卒業
2008 年8月 ノースカロライナ大学チャペルヒル校 Department of Biology 修了
2008 年8月 博士(Ph.D in Biology)(ノースカロライナ大学) 取得
2008年9月〜2010年3月:
科学技術振興機構 戦略的創造研究推進事業研究員(京都大学再生医科学研究所)
2010年4月〜2012年3月:
日本学術振興会 特別研究員SPD(京都大学再生医科学研究所)
2012年4月〜平成2015年3月:
大阪大学大学院 生命機能研究科/医学系研究科 助教
2015年4月〜:
山口大学共同獣医学部 病態制御学講座 獣医衛生学分野 助教
◯ 今まで取り組んできた研究-アミノ酸の代謝メカニズム
私が現在取り組んでいる研究は、細胞内で行われているタンパク質の合成と分解に関するものです。栄養としてのタンパク質は、炭水化物・脂質とともに3大栄養素として重要だとよく言われます。食物中のタンパク質は私たちの体に取り込まれた後、その大部分が「アミノ酸」という、タンパク質の構成単位である物質に分解されてから吸収され、体中の細胞隅々にまで行き渡ります。細胞の周りにアミノ酸がたくさん存在する時、つまり栄養が豊富な状態の時に、細胞は積極的にアミノ酸をタンパク質へと合成するという合理的な応答をするのですが、その際に活躍するのが細胞内にある「mTORC1」という分子複合体です。ややこしいと思われるかもしれませんが、タンパク質合成を制御するこのmTORC1自体も、アミノ酸から再構成されたタンパク質の一つです。mTORC1は、アミノ酸が豊富な時にそれを感知してタンパク質合成装置を活性化させるので、上のような合理的な細胞応答を起こすことができます。
アミノ酸がmTORC1を活性化することは以前から知られていた事でしたが、どのようなメカニズムでそうなるのかは明らかにされていませんでした。しかし、2008年頃からの一連の研究報告で、アミノ酸が細胞内の「リソソーム」という器官に入った時にmTORC1を活性化させることが明らかになりました。つまり、リソソームにアミノ酸センサーや、mTORC1活性化に必要な分子群が存在することが発見されたのです。では、アミノ酸はどのような経路でリソソームの中に取り込まれていくのでしょうか?
我々は今回、この経路の1つを解明しました。
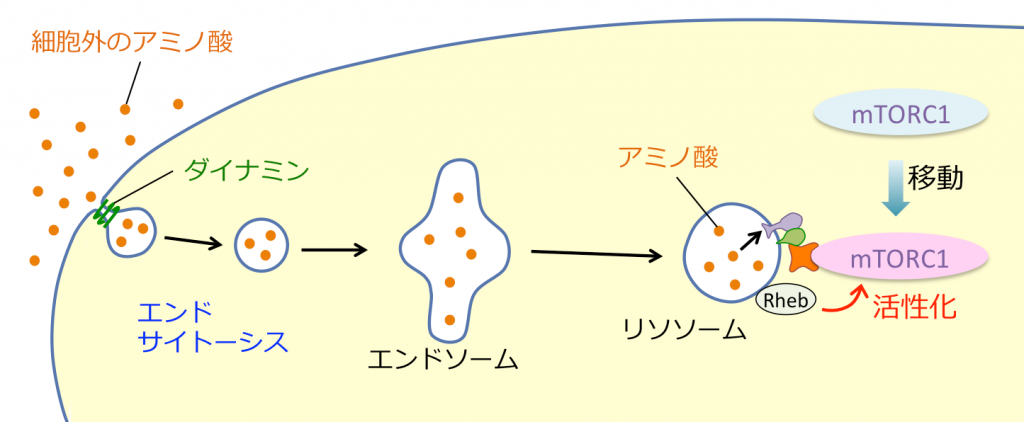
アミノ酸はそのままの状態では細胞膜を上手く通り抜けることができません。昔から言われていたのは、細胞膜にある「トランスポーター」という、タンパク質で出来た穴を通って細胞の中に入ってくるという説です。また他にも、「エンドサイトーシス」とよばれる経路が存在します(上図)。エンドーシスにおいては、まず細胞膜に局所的な陥没が起こり、その後、陥没した部分が細胞膜から切り離されて、袋のような形で細胞の内部に取り込まれます。そしてこの袋とリソソームが融合するという経路をたどります。エンドサイトーシス自体は昔からよく知られていますが、私はアミノ酸の取り込みに関して、トランスポーターを利用する経路だけでなく、このエンドサイトーシスを用いた経路を使っているのではないかと考え、それを実験的に示すことに成功しました。エンドサイトーシスが起こる際に、陥没した細胞膜の部分に「ダイナミン」と呼ばれるタンパク質が、袋の口を締めるようにリング状にまとわりついてくるのですが、このダイナミンを阻害するとリソソームでのmTORC1活性化が起こらなくなったのです(上図)。
このように、エンドサイトーシスを阻害するとmTORC1が不活化されることが分かったのですが、この結果として、タンパク質合成が抑制されることと同時に、「オートファジー」という細胞内分解装置が活性化されると予想されます。オートファジーを制御している主要因子がmTORC1だからです。普段、細胞周辺にアミノ酸が存在するときには、mTORC1は活性化されてオートファジーを抑制し続けています。逆に、細胞周辺のアミノ酸が無くなってくるとmTORC1の活性が弱まり、オートファジーは抑制が外れて活発になります。したがって、アミノ酸欠乏時には「オートファジーで自分のタンパク質を壊してアミノ酸を供給する」という補償機構が働きます。スクラップ&ビルド方式で、新たなタンパク質合成のためのアミノ酸を確保するのです。
しかし、アミノ酸欠乏時とは違って、エンドサイトーシス阻害時に起こるmTORC1抑制の場合、補償機構としてのオートファジーが活性化されてもおかしくないのに、逆に抑制されていました。これは一見理屈に合わないのですが、過去の研究報告では、オートファジー活性を保つのにエンドサイトーシスが必要だと言う報告があり、この因果関係自体はすでに知られていたことではあります。いずれにしろ、エンドサイトーシス阻害剤がアミノ酸の供給経路を、エンドサイトーシスを介した外からの経路も、オートファジーを介した内からの経路も両方同時に絶ってしまう、強力な栄養利用阻害剤として作用するということが分かりました。
◯ 今後の展望
エンドサイトーシスがmTORC1を活性化している経路だと分かったことを踏まえて、今後は薬剤などでエンドサイトーシスを止めた時に細胞の中で何か起こるのか、もう少し詳しく調べていきたいと考えています。
エンドサイトーシスを抑制することでmTORC1の活性化を抑えることができ、さらに細胞内への栄養取り込みと細胞内での栄養素生成も抑制できます。エンドサイトーシス阻害剤を用いて、栄養が豊富にある状態でも細胞の栄養利用を適度に抑えることができれば、過剰な栄養摂取に起因する肥満や、それに付随する生活習慣病の予防薬・治療薬の開発につながる可能性もあるのではないかと期待しています。また、がんや老化にmTORC1が関係していることが知られています。例えば、がん細胞ではmTORC1の活性が過剰になる遺伝子変異が多く見つかります。一方、食事から得るカロリーを抑えると老化が抑制されるという報告がありますが、mTORC1の抑制剤の投与でも同様に老化抑制が起こることが知られています。がんや老化に対して、エンドサイトーシスが有効なターゲットになるかも知れません。
食事や栄養は我々の生活を根本から支える、生きる上で必要な基本要素です。この基本要素に関連する身体や細胞の機能を解明していきたいと考えています。

◯ 現在に至るまで―「自分の体の中で何が起こっているのか?」を明らかにしたい
私自身は、小学生の頃から漠然と研究者になりたいと考えていました。高校生になって「自分の体の中の、見えないところで何か起こっているのか知りたい」という思いを持ち、生物を学ぶことができる学部を希望しました。そして、生物の全体像がつかめるのでないかという期待を持って獣医学科に進学しました。学部卒業後にはアメリカに大学院留学しました。これから研究する上で英語が必要になると考え、今から身に着けておくべきだと感じたのが大きな理由の1つでした。実際には、留学先では実験作業をしている時間と、アパートと実験室との往復で年月が過ぎていき、英語を話す機会は十分ではなかった気がします。しかし、さすがに5年間も滞在したので、研究においては英語をある程度使えるようにはなりました。
◯ 学生へのメッセージ
私が研究をしてきた中で特に楽しさを感じたのは、実験で顕微鏡を覗いていた時です。顕微鏡を覗くと、肉眼では見えない世界を垣間見る事が出来ます。自分が初めて発見したと思われる現象を目にした瞬間は特別で、忘れ難い経験です。このような瞬間があるからこそ仕事を続けたくなるのだと思います。今も私は自分の興味に従って研究に取り組むことが出来ており、とても幸せなことだと感じています。なにより、未知の領域に踏み込み、既知の領域を広げていくという壮大な作業に、微力ながら関われることは素晴らしいことだと思います。

エンドサイトーシス阻害剤を用いると、mTORC1(緑色)はリソソームから外れて細胞全体に散らばるが、リソソームに繋ぎ止める分子であるRag(赤色)を遺伝子導入した細胞においては、リソソーム様の点状の構造に集積した。青色は細胞核。
学生の皆さんに伝えたいのは、自分が興味を持てたものがあれば大切にし、是非それを軸足にして、生産的な活動を続けてほしいということです。自分の生活の中心に据えたくなるほど興味が持てるものというのは、そう頻繁に見つかるものではないと思います。自分が興味を持てて、これは追い求めるに値すると思ったことを、納得行くまでやってみることが重要ではないでしょうか。
取材担当:谷 綺音(広島大学 総合科学研究科 博士課程後期1年)






